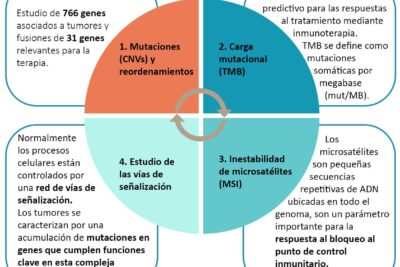
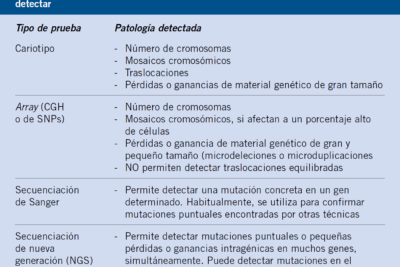
Qué técnicas se utilizan para identificar mutaciones

Las mutaciones son cambios en la secuencia de nucleótidos del ADN que pueden tener un impacto significativo en la función de los genes y, por ende, en el desarrollo y la salud de los organismos. Identificar y entender estas mutaciones es crucial para diversas ramas de la biología, la medicina y la evolución. Un conocimiento profundo de las técnicas utilizadas para detectar mutaciones puede aportar valiosos conocimientos sobre enfermedades genéticas, cáncer y evolución de las especies.
Este artículo se centra en las diversas técnicas utilizadas para identificar mutaciones en el ADN, explorando métodos tradicionales y avanzados, así como sus aplicaciones y limitaciones. Desde las técnicas de secuenciación hasta los métodos de PCR (reacción en cadena de la polimerasa), cada enfoque tiene sus particularidades que lo hacen adecuado para diferentes situaciones. Acompáñenos en este recorrido por el fascinante mundo de la detección de mutaciones.
Técnicas de secuenciación de ADN
La secuenciación de ADN es uno de los métodos más poderosos y utilizados para identificar mutaciones. Este proceso implica determinar el orden de los nucleótidos en un fragmento de ADN. Las dos técnicas más reconocidas de secuenciación son la secuenciación Sanger, desarrollada por Frederick Sanger en los años 70, y la secuenciación de nueva generación (NGS por sus siglas en inglés). La secuenciación Sanger, aunque ha sido reemplazada en gran medida por técnicas más avanzadas, sigue siendo valiosa para la validación de resultados y secuenciación de segmentos cortos.
La secuenciación de nueva generación, por otro lado, permite analizar millones de fragmentos de ADN simultáneamente, lo que resulta en una velocidad y un coste significativamente mejores en comparación con la secuenciación Sanger. Esta capacidad de procesamiento masivo ha revolucionado campos como la genómica clínica y la investigación de enfermedades de origen genético. A través de NGS, los científicos pueden identificar mutaciones en genes específicos que están asociados con diversas condiciones médicas, como cáncer hereditario y trastornos genéticos raros.
Técnicas de amplificación de ADN
Las técnicas de amplificación, como la reacción en cadena de la polimerasa (PCR), son fundamentales para la detección de mutaciones, particularmente cuando se trabaja con muestras de ADN que pueden ser escasas o degradadas. PCR permite ampliar una región específica del ADN, facilitando su posterior análisis. Esta técnica es extremadamente sensible y puede detectar incluso mutaciones que están presentes en pequeñas proporciones de la muestra original.
El uso de PCR se ha adaptado a diversas aplicaciones, incluyendo el diagnóstico de enfermedades, la identificación de patógenos en microbiología y la amplificación de ADN para investigaciones forenses. Variantes de la PCR, como la PCR en tiempo real (qPCR), no solo amplifican el ADN sino que también permiten cuantificarlo en tiempo real, brindando detalles sobre la carga mutacional en las células analizadas, lo que puede ser un indicador de la progresión de diversas enfermedades.
Análisis de microarreglos
Los microarreglos son otra técnica valiosa para el estudio de mutaciones, especialmente en el contexto de la genómica. Esta tecnología permite la evaluación simultánea de la expresión de miles de genes y puede identificar cambios en los niveles de expresión que pueden correlacionarse con mutaciones en el ADN. En el análisis de microarreglos, se utilizan pequeños fragmentos de ADN, conocidos como sondas, que se hibridan con el ADN de la muestra; la intensidad de la señal que se genera puede indicar la presencia de mutaciones o variaciones en el número de copias.
Esta técnica ha sido especialmente útil en la investigación del cáncer, donde se busca comprender cómo las mutaciones afectan la expresión de genes que pueden conducir a la proliferación celular descontrolada. Los microarreglos también han sido utilizados para la identificación de biomarcadores que pueden predecir la respuesta a tratamientos específicos en pacientes oncológicos.
Edición genética y estudios funcionales
La edición genética, facilitada por tecnologías como CRISPR-Cas9, ha abierto nuevas puertas en la identificación y estudio de mutaciones. Esta técnica permite a los investigadores editar secuencias específicas de ADN con gran precisión, permitiendo no solo la corrección de mutaciones sino también el estudio de sus efectos al inducir cambios específicos en el genoma de organismos modeladores. A través de la creación de modelos de enfermedad que llevan mutaciones específicas, los científicos pueden observar cómo estas alteraciones afectan el desenvolvimiento de la enfermedad y testear potenciales tratamientos.
Lo fascinante de la edición genética es su capacidad para identificar no solo mutaciones patogénicas, sino también para explorar la función de genes que pueden no haber sido previamente asociados con una enfermedad. De esta forma, la edición genética se convierte en una herramienta poderosa no solo para la detección, sino también para la comprensión de las implicaciones biológicas de las mutaciones en un contexto más amplio.
Aplicaciones clínicas de la identificación de mutaciones
La identificación de mutaciones tiene importantes implicaciones en la medicina personalizada. Conocer el perfil mutacional de un paciente puede informar decisiones sobre tratamientos específicos y prognosis. Por ejemplo, se ha demostrado que ciertas mutaciones en genes como BRCA1 y BRCA2 están asociadas con un mayor riesgo de cáncer de mama y ovario, y las pruebas genéticas para estas mutaciones ahora se ofrecen como parte del cuidado preventivo para individuos en riesgo.
Además de la oncología, la identificación de mutaciones es esencial en el diagnóstico de enfermedades genéticas raras. Gracias a las técnicas de secuenciación y PCR, los genetistas pueden identificar alteraciones en genes individuales que podrían ser responsables de síntomas inexplicables en pacientes. Esto no solo facilita el diagnóstico correcto, sino que también abre la puerta a opciones terapéuticas específicas y asesoramiento genético para las familias afectadas por estas condiciones.
Limitaciones y desafíos en la identificación de mutaciones
A pesar de los avances en las técnicas de identificación de mutaciones, existen ciertas limitaciones y desafíos que deben ser considerados. Algunos métodos pueden no detectar mutaciones que ocurren en regiones del ADN que no se secuencian adecuadamente o variantes que son de tipo estructural, que pueden requerir enfoques más complejos para su análisis. Además, la interpretación de las variaciones genéticas puede resultar complicada, especialmente cuando se trata de mutaciones que no han sido ampliamente estudiadas.
Otro desafío es el costo asociado a algunas de estas técnicas, especialmente las de secuenciación de nueva generación, que pueden resultar prohibitivas en contextos de atención médica en países en desarrollo. También es vital tener en cuenta la necesidad de un marco ético adecuado para el manejo de información genética, dada la sensibilidad de los datos recolectados y su potencial impacto en la privacidad y la discriminación laboral.
Conclusión
La identificación de mutaciones es una disciplina fundamental que permite desentrañar el complejo entramado de la genética y su relación con la salud y la enfermedad. A través de técnicas como la secuenciación de ADN, PCR, análisis de microarreglos y edición genética, los científicos logran no solo detectar mutaciones, sino también entender sus implicaciones biológicas y clínicas. A medida que la ciencia avanza, se van desarrollando nuevas tecnologías y enfoques que hacen más accesible y precisa la identificación de estas alteraciones. Sin embargo, es crucial abordar los desafíos que ello conlleva para asegurar que los beneficios de estos avances sean universalmente accesibles y utilizados de manera ética. En última instancia, la comprensión de las mutaciones y su impacto es esencial para avanzar en medicina personalizada y mejorar la salud de las poblaciones en todo el mundo.


Leave a Reply